1. Esami di laboratorio
Le uveiti sono un processo dinamico pertanto non esiste una valutazione
diagnostica standard (ad eccezione della sifilide e della sarcoidosi). Il
momento decisivo nel processo diagnostico è decidere quali esami richiedere.
Smith e Nozik raccomandano una strategia chiamata “ name meshing” [5]. Il
processo di naming implica l’estrazione di informazioni cliniche e anamnestiche
rilevanti per creare un profilo del paziente. Con l’utilizzo di queste
informazioni il clinico può formulare una lista di diagnosi differenziali e
richiedere così dei test di laboratorio basati sulla probabilità che una di
queste patologie possa essere la causa. Prescrivere infatti una serie standard
di test in ogni paziente con uveite raramente è utile, è costoso e spesso può
confondere il processo diagnostico [6]. La valutazione degli esami da richiedere
varia con la probabilità della malattia sospettata (pretest probabilità). E’ il
clinico a decidere quale test diagnostico fare basandosi sull’evidenza clinica
migliore. Sackett e colleghi hanno coniato il termine evidence-based medicine,
che è “il coscienzioso, esplicito e giudizioso utilizzo della miglior evidenza
attuale nel prendere decisioni relative alla cura degli individui” [7].
L’effettuazione degli esami abitualmente richiesti nell’indagine
immunopatologica è di competenza del laboratorio di analisi clinico-ematologiche,
della microbiologia, del centro trasfusionale.
• Esame emocromocitometrico: è un esame di laboratorio di interesse generale. In
corso di malattie virali è frequente una leucopenia con linfocitosi relativa
mentre nelle infezioni batteriche è caratteristica una leucocitosi con
neutrofilia. L’eosinofilia può essere indicativa di malattie parassitarie,
allergiche, cutanee croniche, emopatie, connettiviti, neoplasie e intossicazioni
da farmaci. Tra le parassitosi le elmintiasi provocano una spiccata
ipereosinofilia.
• Velocità di eritrosedimentazione (VES) e proteina C-reattiva (PCR): l’aumento
della VES è un segno aspecifico di processi infiammatori sistemici in fase di
attività. Falsi negativi si possono avere in presenza di anisocitosi,
sferocitosi, iperglicemia ed epatopatie. Nelle donne e negli anziani i valori
normali (fino 25mm/h) sono più alti rispetto a quelli riscontrabili nel sesso
maschile e nei bambini (fino a 15mm/h). I livelli della PCR seguono quelli della
VES e possiedono lo stesso significato clinico con maggiore specificità. Nelle
infiammazioni acute la PCR aumenta più precocemente per poi diminuire più
rapidamente rispetto alla VES.
• Fibrinogeno: è una glicoproteina del plasma sanguigno i cui valori normali
variano da 200 a 400 mg/dl. I suoi valori sono alterati nelle infezioni gravi,
emorragie, gravidanza e nella coagulazione intravascolare disseminata (CID).
• Protidogramma: si esegue con l’elettroforesi delle proteine sieriche che
vengono separate in 4 frazioni principali: albumine,
a-globuline,
b-globuline,
g-globuline; a quest’ultima frazione appartiene la maggior parte degli
anticorpi. Oltre alla valutazione dei livelli delle singole classi, è utile lo
studio del rapporto albumina/globulina (A/G). Nelle malattie del collageno
(esempio l’artrite reumatoide), nelle infezioni croniche, nella sarcoidosi e nel
mieloma multiplo, si ha una riduzione del rapporto A/G (v.n.1,2-2) per un
aumento delle g-globuline. Un aumento delle IgG si riscontra in corso di
infezioni croniche, mentre alti livelli di IgM sono indicativi di un’infezione
recente attiva, un aumento delle IgA di un’infezione delle mucose e un aumento
delle IgE di parassitosi o di malattie allergiche.
• Complementemia: C3 è una proteina del complemento che viene attivata quando
l’organismo riconosce la presenza di cellule batteriche o di immunocomplessi.
Aumenta in corso di malattie autoimmuni, infiammazioni, infezioni coniche. C4 è
una proteina che viene attivata dalla presenza di anticorpi o complessi di
anticorpi. Aumenta come il C3 nelle malattie autoimmuni, infiammazioni e
infezioni croniche.
• HLA: HLA è una famiglia di glicoproteine espresse su quasi tutte le cellule
del corpo. Sono divise in due classi a seconda della loro distribuzione: tipo I
ubiquitarie ma maggiormente espresse sulla superficie dei linfociti T e tipo II
che hanno una distribuzione limitata ai linfociti B, ai macrofagi. Gli HLA sono
anche divisi in base alla posizione del gene sul braccio corto del cromosoma 6 (HLA-A,
-B, -C per la classe I, e HLA-DR, -DQ, -DP per la classe II). La tipizzazione
non ha di per sé un valore diagnostico ma può fornire utili indicazioni per la
conferma di un sospetto diagnostico o prognostico (Tab. 1) [8].
|
Tab. 1. Associazione tra HLA e malattie infiammatorie oculari [8] |
|
|
Uveite anteriore acuta |
HLA-B27 |
|
Sindrome di Reiter |
HLA-B27 |
|
Atrite idiopatica giovanile |
HLA-DR4, -Dw2 |
|
M. di Behçet |
HLA-B51 |
|
Retinocoroidopatia tipo Birdshot |
HLA-A29, -A29.2 |
|
Uveite intermedia |
HLA-B8, -B51, -DR2, -DR15 |
|
Oftalmia simpatica |
HLA-DR4 |
|
VKH |
HLA-DR4 |
|
Sarcoidosi |
HLA-B8, -B13 |
|
Sclerosi multipla |
HLA-B7, -DR2 |
|
Istoplasmosi oculare |
HLA-B7, -DR2 |
|
Vaculite retinica |
HLA-B44 |
• Autoanticorpi: l’occhio viene considerato un
organo immunoprivilegiato e lo sviluppo di malattie autoimmuni a carico delle
strutture oculari richiede l’attivazione di una serie complessa di meccanismi
immunopatogenetici [9]. FR (Rheumatoid factor) è un autoanticorpo diretto contro
una IgG dello stesso paziente. Alti livelli sono indicativi di artrite
reumatoide (80%) e di sindrome di Sjogren (100%) [10]. Ha tuttavia uno scarso
impiego poiché risultati positivi possono essere dovuti ad altre cause come le
epatiti, infezioni croniche virali, la leucemia, le dermatomiositi, la
sclerodermia ed il LES, mentre i risultati negativi non escludono la malattia.
Il test viene occasionalmente chiamato anche Waaler-Rose ed è positivo per
livelli di FR >20 U/mL, >1:40 o > 95° percentile (a seconda del laboratorio).
ANA (Anti-nuclear antibodies): sono anticorpi diretti contro componenti del
nucleo cellulare e sono elevati nel 5% della popolazione e la metà di questi ha
una patologia autoimmunitaria. Il titolo normale è 1:40. Titoli elevati (esempio
1:160) sono indicativi di LES (80-90% dei casi), sindrome di Sjögren (60%),
dermatomiosite (30%), artrite reumatoide, epatiti autoimmuni, sclerodermia,
polimiosite e dermatomiosite. Quando si riscontra un elevato titolo di ANA si
procede a determinarne i diversi sottotipi [11]:
Anti-ENA (extractable nuclear antigen)
• anti-Ro (SS-A)
• anti-La (SS-B)
• Anti-Sm (Smith antigen)
• Anti-nRNP (nuclear ribonucleoproteins)
• Anti-Scl-70 (Topoisomerase I)
• Anti-Jo
Anti-gp-210 cirrosi biliare primitiva
Anti-p62 cirrosi biliare primitiva
Anti-dsDNA (double-stranded DNA)
Anti-centromero per la syndrome CREST e la sclerodermia
ASMA (Anti-smooth muscle antibody): sono indice di patologie autoimmunitarie
come epatiti, cirrosi e LES. ANCA (Anti-neutrophil cytoplasmic antibodies): sono
un gruppo di autoanticorpi IgG contro antigeni presenti nel citoplasma di
granulociti neutrofili. Sono divisi in due classi: c-ANCA e p-ANCA. Tre sono le
malattie associate in maniera molto stretta con gli ANCA: la granulomatosi di
Wegener, la poliangite microscopica e la glomerulonefrite. AMA (antimitochondrial
antibodies): sono un test di screening per la cirrosi biliare primitiva,
l’epatite cronica attiva, il lupus eritematoso sistemico, l’anemia perniciosa,
l’artrite reumatoide e il morbo di Addison. Lupus anticoagulant (Antiphospholipid
antitibodies) interferisce con la cascata coagulativa ed è legato ad un maggior
rischio di fenomeno trombotici. E’ espresso, ma non costantemente, nel lupus
eritematoso sistemico.
• Sifilide : RPR (rapid plasma reagin) è un test di screening per sifilide. Può
dare falsi positivi in HBV, epatiti, varicella, linfoma, TBC, malaria,
endocarditi, gravidanza e malattie del connettivo. Un altro test più spesso
usato è il VDRL (Venereal Disease Research Laboratory). Questi due test di
screening dovrebbero essere sempre seguiti da esami più specifici basati
sull’impiego di anticorpi monoclonali e l’ immunofluorescenza quali il TPHA
(Treponema Pallidum Hemoagglutination Assay) e il FTA-ABS (Fluorescent
Treponemal Antibody Absorption) che sono più specifici e più costosi.
• Sarcoidosi: ACE (Angiotensin-Converting Enzyme) è un enzima che viene
rilasciato a livello del tessuto granulomatoso ed ha una specificità del 95%. Si
considerano normali valori di 12-35 nmol/min/ml negli uomini e di 11-29 nmol/min/ml
nelle donne; livelli aumentati sono fisiologici nei bambini. Valori negativi si
riscontrano in corso di sarcoidosi in remissione e durante la terapia steroidea.
Lisozima: è un enzima rilasciato da macrofagi attivati; livelli elevati si
possono riscontrare in corso di malattie granulomatose come la sarcoidosi, la
lebbra e la TBC. E’ meno sensibile e specifico dell’ACE.
• LES: gli ANA sono usati come test di screening, hanno una sensibilità del 95%
anche se non sono diagnostici senza le manifestazioni cliniche. Alti titoli sono
più specifici (>1:160). Altri esami come gli anticorpi anti DNA nativo (dsDNA) o
gli anticorpi anti-Sm sono più specifici e vengono usati per confermare la
presenza del LES. Le proteine del complemento aiutano nella diagnosi e sono
utilizzate per monitorare l’andamento della malattia. Se sono presenti gli
anticorpi antifosfolipidi questo non solo aiuta nella diagnosi ma indica anche
il rischio di sviluppare alcune specifiche complicanze della malattia.
• Artrite reumatoide: FR e ANA (vedi sopra).
• Tubercolosi: Mantoux test (PPD test): è il test diagnostico per la
tubercolosi. Nella pratica clinica si è visto che una risposta infiammatoria di
diametro superiore ai 15 mm è nella maggioranza dei casi indice di un soggetto
con un’infezione in atto. Il risultato è positivo in soggetti vaccinati contro
il batterio della tubercolosi e in soggetti che hanno subito un’infezione in
passato o che sono infetti al momento stesso del test. Falsi positivi sono
causati da micobatteri non tubercolari o per pregressa vaccinazione contro la
TBC. I casi di anergia sono riconducibili ad immunodepressione come AIDS o in
caso di sarcoidosi. Quantiferon TB test (QFT) è una tecnica più recente basata
sulla quantificazione dell’IFN- rilasciato dai linfociti sensibilizzati dalla
PPD. Rispetto agli altri test il Quantiferon è meno esposto ad errori di lettura
(Tab.2).
|
Tab. 2. Confronto tra test per infezione tubercolare latente [12] |
||
|
|
IFN-γ |
Mantoux |
|
Sensibilità |
89.0% |
65.7% |
|
Specificità |
98.2% |
35.4% |
• Borreliosi (m. di Lyme): si esegue per primo il
test ELISA. Il solo test ELISA può risultare falsamente positivo in caso di
sifilide, nella febbre intermittente Rocky Mountain e nelle malattie autoimmuni.
Per tale motivo si esegue successivamente per la conferma il Western Blot che ha
una specificità del 94-96%. Si può eseguire anche la PCR (Polymerase Chain
Reaction) che raramente dà errori falsi positivi, ma più frequentemente falsi
negativi.
• Toxocariasi: si esegue il test ELISA, ipereosinofilia e aumento delle IgE.
Nelle forme oculari di Toxocariasi nelle quali l’eosinofilia non è frequente e i
titoli anticorpali sierici possono non essere significativi, particolare
importanza riveste la determinazione degli anticorpi specifici nell’umore acqueo
e nel vitreo [13].
• Citomegalovirus: si esegue la ricerca sierologica degli anticorpi con ELISA,
oppure la ricerca diretta del virus con PCR su campioni biologici.
• Toxoplasmosi: le indagini sierologiche per la toxoplasmosi sono utili per la
conferma della diagnosi clinica di toxoplasmosi oculare. La reazione di
emoagglutinazione, il test ELISA e la reazione di immunofluorescenza indiretta
hanno una sensibilità e una specificità sovrapponibili. Per poter interpretare i
risultati bisogna tener presenti le modalità e i tempi di insorgenza con cui
l’organismo risponde allo stimolo antigenico. Le IgM compaiono dopo 5 giorni
dall’infezione e tendono a scomparire con l’inattivazione dell’infezione, le IgG
specifiche invece compaiono dopo 15 giorni circa dall’infezione, raggiungono
livelli massimi dopo 2 mesi per poi rimanere bassi per tutta la vita. Da tenere
presente che in corso di toxoplasmosi oculare non si hanno generalmente segni di
attività sierologica, ma piuttosto livelli anticorpali non elevati senza alcuna
correlazione con la gravità dei sintomi oculari ed inoltre che
approssimativamente dal 20 al 70 % della popolazione adulta è positiva per gli
anticorpi anti-toxoplasma [14]. Nella tabella 3 sono riassunti i possibili
pattern anticorpali.
| Tab. 3. Pattern anticorpali | ||
| IgM | IgG | Interpretazione |
| + | - | Possibile infezione recente |
| + | + |
Possibilità di persistenza delle IgM Non fornisce indicazioni sull’evoluzione dell’infezione |
| - | + | Corrisponde a pregressa infezione |
| - | - | Assenza di immunizzazione |
• HSV/HZV: test sierologici sono di scarso valore,
poiché il 90% della popolazione adulta presenta valori positivi; l’eventuale PCR
su campioni biologici (umor acqueo, umor vitreo) può essere utile nei casi
difficili, nei quali sia necessaria una diagnosi tempestiva (esempio la necrosi
retinica acuta).
2. Fluorangiografia
Nella diagnosi delle patologie infiammatorie oculari ci si avvale da molti anni
ormai della fluorangiografia (FAG) che, grazie all’impermeabilità delle barriere
ematoretiniche alla molecola fluoresceina (F), è un esame strumentale
particolarmente utile nello studio delle strutture superficiali del fondo
oculare. La fluoresceina è un colorante organico la cui molecola ha un peso di
376 Dalton, è idrosolubile e, una volta iniettata per via endovenosa, il 70-80%
di esse fissa debolmente alle proteine plasmatiche di piccole dimensioni. Per la
corretta interpretazione di una FAG occorre ricordare il caratteristico
comportamento della molecola di F nelle strutture vascolari della coroide e
della retina. Il sistema vascolare della coroide è dotato a livello capillare di
uno strato di cellule fenestrato. La presenza di questi spazi fra le cellule
endoteliali fa in modo che la coriocapillare sia permeabile alla F. Il sistema
vascolare retinico è reso invece impermeabile da cellule endoteliali unite dalle
cosiddette “tight junction” che non consentono la fuoriuscita dal lume capillare
di grandi molecole compresa la F. Questa è la barriera ematoretinica interna. La
barriera ematoretinica esterna è invece costituita dallo strato delle cellule
dell’epitelio pigmentato, anch’esse collegate tra di loro dalle tight junction.
Tale barriera separa la circolazione coroideale , con il suo compartimento
extracellulare che viene impregnato di F, dallo spazio sottoretinico e dal
compartimento extracellulare che non è impregnato di F in condizioni
fisiologiche. Inoltre l’epitelio pigmentato ha la capacità di assorbire
l’essudato sottoretinico e funge da filtro, soprattutto nella regione del polo
posteriore dove le cellule sono più ricche di melanina, proteggendo così la
coroide da radiazioni termiche troppo intense. Nello stesso tempo può assorbire
buona parte della fluorescenza emessa dalla F. La F, una volta iniettata nella
vena cubitale, dopo circa 10-15 secondi entra nel circolo coroideale tramite le
arterie ciliari brevi. Il flusso ematico coroideale è estremamente rapido e le
molecole di F diffondono rapidamente dalla coriocapillare fenestrata impedendo
di fatto l’esplorazione delle strutture coroideali a parte la coriocapillare
nelle fasi più precoci dell’angiografia.
La papillite si presenta con un’iperfluorescenza precoce del disco ottico con
leakage nelle fasi tardive per una iperpermeabilità dei capillari della papilla.
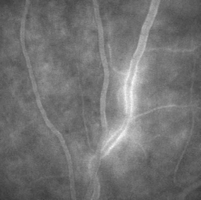
La vasculite retinica può interessare i vasi arteriosi e allora la FAG documenta
la presenza di aree di non perfusione capillare, o può interessare
prevalentemente i vasi venosi con un’iperfluorescenza delle pareti vasali per
impregnazione con leakage perivasale (Fig. 1a), oppure l’infiammazione può
coinvolgere soprattutto il circolo capillare retinico e allora la FAG documenta
la presenza di una rottura della barriera ematoretinica interna con leakage che
può interessare la periferia retinica, coinvolgere tutto l’ambito retinico,
formare edema maculare cistoide quando sono coinvolti i capillari perifoveali. A
livello dell’epitelio pigmentato la FAG documenta gli esiti cicatriziali
(effetto finestra-effetto maschera) e la presenza di punti di diffusione (pinpoints)
con accumulo di colorante nelle fasi tardive dello spazio sottoretinico. Le
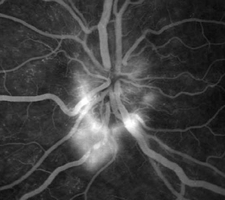
neovascolarizzazioni epipapillari (Fig. 1b), epiretiniche e coroideali sono
possibili complicanze evidenziabili alla FAG. Nel caso di coinvolgimento della
coroicapillare nel processo infiammatorio (coriocapillariti), la FAG documenta
nei tempi precoci la presenza di aree ipofluorescenti (Fig. 1c) che indicano la
non perfusione della coriocapillare seguite, nei tempi tardivi, da leakage più o
meno evidente a seconda della severità dell’insulto ischemico a livello della
retina esterna.
Figura 1
 |
 |
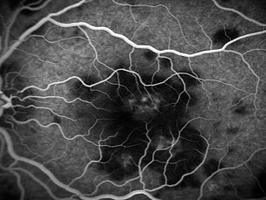 |
| a. Vasculite | b. Neovascolarizzazione papillare | c. Coriocapillarite |
3. Angiografia al verde di indocianina
Lo studio con l’angiografia al verde di indocianina (ICGA) ha permesso di
allargare le nostre conoscenze sulle malattie della coroide e sulla componente
coroideale delle malattie retiniche che prima non era possibile osservare [15].
Il verde indocianina (ICG) è una molecola dal peso di 775 Dalton, idrosolubile,
la cui differenza cruciale dalla fluoresceina è l’elevata affinità proteica
(98%). Questo fa in modo che mentre la fluoresceina fuoriesce da piccoli vasi
retinici danneggiati, l’ICG fuoriesce solo da grossi vasi retinici danneggiati e
che quindi non vi sia essudazione dai vasi retinici infiammati. Nella coroide
comunque l’ICG fuoriesce, lentamente, dai vasi della coriocapillare integri.
Durante il ricircolo l’ICG rimane intrappolata nel tessuto coroideale. La
graduale impregnazione della coroide determina la fluorescenza intermedia e
tardiva della coroide. Questa impregnazione della coroide è disturbata da
lesioni infiammatorie della coroide, determinando aree di riduzione o di assenza
della fluorescenza o in alternativa aree di aumentata fluorescenza.
Contrariamente alla fluorangiografia, dove ogni reperto ha un’interpretazione
precisa, il significato dell’angiogramma al verde di indocianina non è ben
accertato in tutti i casi e per certe patologie le interpretazioni sono ancora
oggetto di discussione. Sicuramente l’ICGA ha contribuito alla riclassificazione
delle coroidopatie sulla base dei due principali meccanismi di infiammazione
coroideale distinguendo le coriocapillaropatie infiammatorie primarie (AMPPE,
MEWDS e coroidite multifocale) caratterizzate da ipofluorescenza lungo tutti i
tempi angiografici dalle coroiditi stromali (VKH, Birdshot, TBC, sarcoidosi)
caratterizzate invece, in linea generale, da ipofluorescenze precoci seguite da
iperfluorescenze tardive. Per la semplificazione della lettura dell’ICGA in
corso di uveiti posteriori Herbort et al [16] hanno proposto un approccio
schematico, che riportiamo di seguito.
Iperfluorescenza all’ICGA:
• pseudofluorescenza: vecchie emorragie, fibrosi
• iperfluorescenza retinica: leakage in caso di esteso danno vascolare retinico
(esempio M. di Behçet)
• iperfluorescenza subretinica: vasi anomali per neovascolarizzazione coroideale
(esempio neovascolarizzazione in corso di toxoplasmosi); pooling da fluido
subretinico; staining tessutale a livello di punti di leakage (esempio VKH,
sclerite posteriore).
• iperfluorescenza coroideale: da leakage presente in alcune malattie
infiammatorie coinvolgenti la coroide con diffusa iperfluorescenza che circonda
aree coroideali ipofluorescenti; da staining tessutale (esempio le coroiditi
granulomatose come la sarcoidosi, la TBC, la sifilide e la coroidite multifocale
attiva che si presentano con iperfluorescenze focali).
Ipofluorescenza all’ICGA:
1. Ipofluorescenza intermedia e tardiva:
• blocco di fluorescenza (persistente): tumori, nevi, tessuti o fluidi spessi o
opachi (fibre mieliniche, emorragie).
• atrofia corioretinica (ipofluorescenza persistente): lesioni atrofiche (iperfluorescenti
alla FAG)
• non perfusione coriocapillare: MEWDS, APMPPE.
• diffusione ICG attraverso coroide danneggiata: cicatrici stroma coroideale (VHK),
lesioni infiammatorie stromali a tutto spessore (Birdshot, VHK, oftalmia
simpatica, sarcoidosi, TBC).
2. Ipofluorescenza intermedia e isofluorescenza/iperfluorescenza tardiva:
• diffusione ICG nella coroide danneggiata da lesioni infiammatorie stromali non
a tutto spessore: sarcoidosi, VHK, TBC, oftalmia simpatica, Birdshot.
4. Tomografia a coerenza ottica
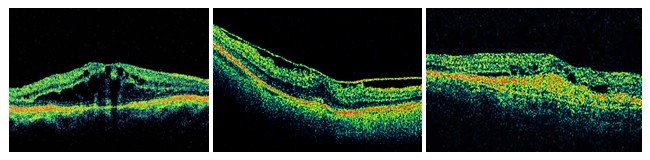
L’OCT (Optical Coherence Tomography) è di grande aiuto nel definire l’eventuale
presenza di edema maculare in corso di flogosi oculari, in particolare della
retinocoroidopatia tipo Birdshot, la sarcoidosi, la pars planite e la forma
HLA-B27 correlata (Fig. 2a). A ciò si aggiunge la possibilità di monitorare la
risposta terapeutica in maniera non invasiva.
L’OCT inoltre può rilevare la possibile comparsa di una complicanza neovascolare
(Fig. 2c) molto frequente nella coroidite multifocale e possibile nella
toxoplasmosi, anche se, proprio per l’aspecificità della lesione riscontrata, è
indiscutibile la necessità di un approfondimento angiografico. In alcuni casi la
flogosi può esprimersi con una vasculite e/o con una vitreite e risolversi con
una proliferazione epiretinica secondaria alla sollecitazione dell’interfaccia
vitreo-retinica. Anche in questo caso è molto utile l’esame OCT (Fig. 2b).
Figura 2 - OCT nelle uveiti
 |
||
|
a. Edema maculare cistoide |
b. Membrana epiretinica |
c. Neovascolarizzazione coroideale |
4. Biomicroscopia ad ultrasuoni
Nei pazienti con uveite la capacità dell’ultrabiomicroscopia (UBM) di esplorare
nei dettagli la camera anteriore, il recesso angolare, il corpo ciliare, la
camere posteriore, la base del vitreo, la retina e la coroide periferica
permette di acquisire nuove informazioni che spesso la concomitante opacità dei
mezzi diottrici non consente di ottenere con le più classiche indagini
semeiologiche. Tali reperti sono dunque di aiuto sia nella formulazione della
diagnosi per un più accurato monitoraggio della patologia, permettendo di
valutare gli effetti della terapia medica e chirurgica. In uno studio condotto
da Herbort [17] su 77 pazienti con sospetta malattia infiammatoria, l’UBM ha
fornito informazioni essenziali per la diagnosi nel 42% dei casi.
Nelle uveiti anteriori l’UBM risulta particolarmente utile nel rilievo di
effusioni sopraciliari e sopracoroideali anche molto ridotte. E’ inoltre in
grado di riconoscere l’atrofia del corpo ciliare o la causa dell’ipotonia in
complicanze quali il distacco trazionale del corpo ciliare ad opera di una
membrana ciclitica.
Nel caso di uveiti intermedie l’UBM può identificare gli snowbanks che si
presentano come addensamenti a riflettività eterogenea medio-alta a livello
della pars plana e dell’ora serrata (Fig. 3).
Figura 3
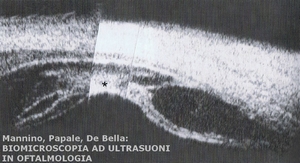 |
|
UBM: Snowbank |
4. Ecografia
L’ecografia gioca un importante ruolo nella valutazione di una grande varietà di
condizioni infiammatorie oculari. E’importante soprattutto quando la risposta
infiammatoria oculare preclude la visualizzazione del segmento posteriore.
I reperti ecografici più comuni sono: la vitreite, le opacità subvitreali,
l’ispessimento dello strato corio-retinico e il distacco di coroide.
Riportiamo alcuni esempi dell’impiego dell’ecografia nelle uveiti:
• Sindrome di Vogt-Koyanagi-Harada: i reperti più significativi sono
l’ispessimento diffuso a riflettività medio-bassa della coroide, solitamente più
pronunciato nella regione peripapillare (Fig. 4a).
• Oftalmia simpatica: l’aspetto ecografico principale, che normalmente interessa
soprattutto l’occhio simpatizzato, è un diffuso ispessimento a bassa-media
riflettività della coroide. Segni associati sono le opacità vitreali, il
distacco retinico sieroso e l’ispessimento sclerale.
• Toxocariasi: i reperti ecografici sono caratteristici anche se non
patognomonici e sono lesioni granulomatose che possono essere calcifiche,
membrane vitreali che si estendono dal polo posteriore alle lesioni
granulomatose e trazioni posteriori retiniche o pieghe retiniche (Fig. 4b).
Figura 4
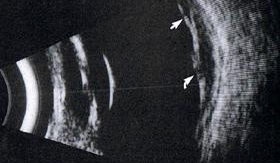 |
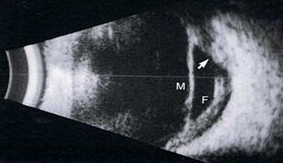 |
| a. VKH | b. Toxocariasi |